Atom
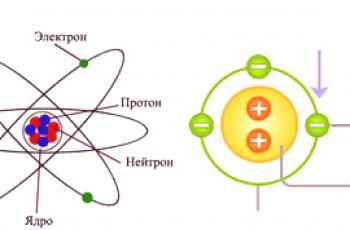
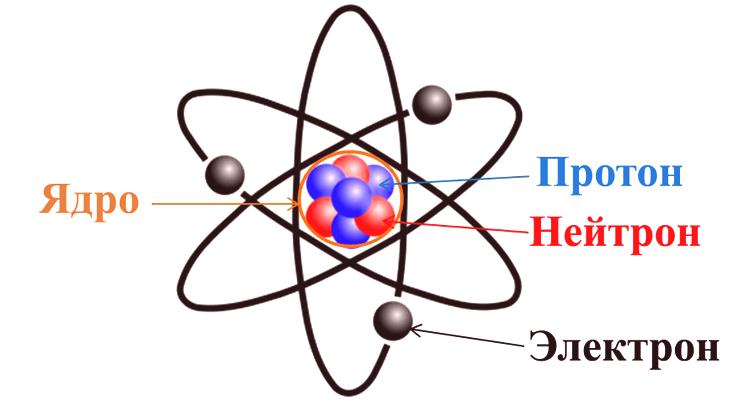
Atom se može smatratielementarnom česticom homogene tvari . Takva se tvar, po definiciji, sastoji samo od jednog kemijskog elementa (C, N, O i drugih iz periodnog sustava). To je najmanji dio takvih elemenata koji može biti nositelj njihovih svojstava koje se naziva atom. Prema najnovijim modernim konceptima, atom se sastoji od tri komponente: protona, neutrona i elektrona.
Atom
Prva dva dijela zajedno čineosnovnu jezgru , koja ima pozitivan naboj. Elektroni koji se kreću oko jezgre unose kompenzacijski naboj s suprotnim predznakom. Tako je napravljen prvi zaključak da je većina atoma električno neutralna. Što se tiče ostalih, zbog različitih fizikalno-kemijskih procesa, atomi mogu ili pričvrstiti ili osloboditi elektrone, što dovodi do naboja. Atom ima masu i veličinu (određenu veličinom jezgre) i određuje kemijska svojstva tvari.
Molekula
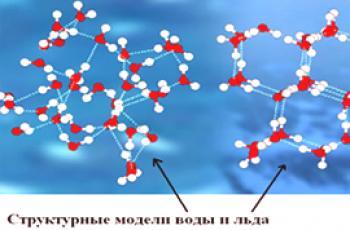
Molekula jeminimalna strukturna jedinica tvari . Takva tvar može se sastojati od nekoliko kemikalijaelementi. Međutim, monoatomska tvar jednog kemijskog elementa, inertnog argona, također se može smatrati molekulom. Poput atoma, električki je neutralan. Molekulu je moguće ionizirati, ali je mnogo teže: atomi unutar molekule povezani su kovalentnim ili ionskim vezama. Stoga postaje mnogo teže pričvrstiti ili pokupiti elektron. Većina molekula ima složenu arhitektonsku strukturu, gdje svaki atom zauzima svoje mjesto unaprijed.
Struktura molekule vode
Atom i molekula: opća svojstva
Struktura . Obje čestice su strukturne jedinice materije. U ovom slučaju atom znači jedan određeni element, molekula već uključuje nekoliko kemijski vezanih atoma, ali struktura (pozitivna jezgra s negativnim elektronima) ostaje ista.
Električna neutralnost . U odsutnosti vanjskih čimbenika - interakcije s drugom kemikalijom, usmjerenim električnim poljem i drugim podražajima - atomi i molekule nemaju nikakvog troška.
Supstitucija . Atom može djelovati kao molekula u jednom slučaju - pri radu s inertnim plinovima. Također se može smatrati i monatomska živa.
Prisutnost mase . Obje čestice imaju svoju čistu masu. U slučaju atoma, masa ovisi o kemijskom elementu i određena je težinom jezgre (proton je gotovo 1500 puta teži od elektrona, stoga se težina negativne čestice često ne uzima u obzir). Masa molekuleodređuje se na temelju njegove kemijske formule - elemenata koji je čine.
Atom i molekula: izvrsna svojstva
Nedjeljivost . Atom je najmanji element iz kojeg je nemoguće odabrati još manju česticu. (Dobivanje iona utječe samo na naboj, ali ne i na težinu). Molekula se pak može podijeliti na manje molekule ili se može rastaviti na atome. Proces raspadanja se lako postiže pomoću kemijskih katalizatora. Ponekad je dovoljno samo zagrijati tvar.
Slobodno postojanje . Molekula može slobodno postojati u prirodi. Atom postoji u slobodnom obliku samo u dva slučaja:
- Kao monoatomska živa ili inertni plin.
- U uvjetima prostora - kao zasebni atomi mogu biti bilo koji kemijski elementi.
Formiranje naboja . Interakcija između jezgre i elektrona u atomu može se lako prevladati čak i pomoću najmanjeg električnog polja. Stoga je lako dobiti pozitivan ili negativan ion iz atoma. Prisutnost kemijskih veza između atoma unutar molekule zahtijeva primjenu mnogo većeg električnog polja ili interakciju s drugom kemijski aktivnom tvari.