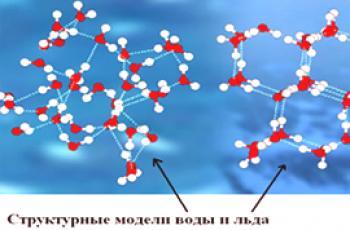
Da bi se ispravno procijenio sastav vode, potrebno je proučiti što je voda u načelu. Kao što je poznato iz lekcija fizike i kemije, voda je tvar (tekućina) koja se sastoji od takvih kemijskih elemenata kao što su vodik i kisik. Voda se nalazi u prirodi u nekoliko stanja, odnosno tri. Na niskim temperaturama kristalizira u ledu, na visokim temperaturama, voda se stvara u vodi, a pod normalnim uvjetima tekućina je voda. 
Voda je dio cjelokupnog života na planeti, osobito ona sadrži u nama ( oko 80% ). Ne možemo postojati bez vode u našem tijelu, jedući hranu koja sadrži tu tekućinu, nadoknađujemo gubitak normalnog života. Ona nema ni miris, ni okus, ali ipak, čovjek i sva živa bića piju vodu, jer trebaju njezinu životvornu moć.
Voda pomaže svim živim organizmima da rastu i napreduju, u svakom agregatnom stanju je potrebno i važno. Dakle, odmrzavanje ledenjaka, daju tlu najkorisnije elemente u tragovima, jer su u čvrstom stanju molekule vode zasićene kisikom, umjesto toga tlo daje biljke, a one pak proizvode kisik, koji je potreban svima. I dalje proizvodi iz kuhinje postaju mnogo ukusniji nakon kiše ili obilnog zalijevanja vodom.
Što se tiče molekule vode, ona se sastoji od atoma vodika i kisika, koji se nalazevrlo blizu jedan drugome . Istovremeno se aktivno kreću i djeluju. Stoga nije nikome tajna da je molekula vode teža od molekule pare, na primjer. U plinovitoj molekulitvari su potpuno različite. Pogledajmo konkretnije o sastavu molekula pare.

Molekule vode
Molekule plinovite tvari - pare
Polazeći od činjenice da je i sama voda teška i lagana, molekule pare takve vode također se mijenjaju. Ali u svakom slučaju, molekula pare bit će lakša od molekule vode. To je zbog činjenice da se atomi koji se kreću u molekuli pare nalaze vrlo daleko i međusobno. Zato zrak s povećanom kombinacijom vlage pri visokoj temperaturi donosi više štete nego koristi. Osoba dugo neće moći disati takav ispušteni zrak. To se odnosi na saunu, gdje je moguće provesti samo nekoliko sati.
Para je agregat, tj. Stanje vezanja tekućine u molekuli, u ovom slučaju vode. Udaljenost između atoma i molekula u paru je mnogo veća od veličine samih molekula. Atomi pare kreću se slučajno i vrlo brzo, ako uzmemo u obzir veliku prostoriju, onda je u kratkom vremenu para može ispuniti. Osim toga, para se može smanjiti, za razliku od vode. U malom prostoru plin se može proširiti i stvoriti pritisak, tako da ako pokrijete posudu parom, ona ga može gurnuti pod pritiskom. 
To su zanimljiva svojstva pare koja se mogu naučiti proučavanjem teorije. U praksi, sve je mnogo zanimljivije, provodeći različite pokuse, možete napraviti mnogo više otkrića na ovu temu. A sada usporedimo dva agregatna stanja vode - tekućina i para. O čemu se radiposebno se razlikuju, što ih ujedinjuje?
Koja je razlika između pare i vode, koja ujedinjuje te dvije države
Molekula vode kao takva, to je molekula pare, temeljena na njihovom sastavu. To je zajednička stvar među njima da jekisik i vodik u jednakim količinamau obje molekule. Može se primijetiti da se oni međusobno odbijaju stalno i brzo, te ih također ujedinjuje među sobom.
Glavne razlike molekule pare od molekule vode:
- Para se sastoji od molekula, gdje se atomi nalaze na udaljenosti većoj od same molekule, ali u vodi je, naprotiv, vrlo blizu.
- Plinovi nemaju oblik i mogu se i smanjiti i proširiti u različitim smjerovima, zbog sile s kojom se atomi i molekule međusobno odbijaju.
- Voda je fluidna, za razliku od pare, ona ima oblik posude u kojoj se nalazi, jer su molekule preblizu jedna drugoj.
- Plin može stvoriti pritisak, kada se molekule međusobno odbijaju, one mogu, primjerice, iz šampanjca gurnuti pluto. I voda ne može vršiti pritisak na objekte, budući da se molekule unutar vode kreću nasumce, umjesto da se sudaraju izravno jedna s drugom.
- Voda je kemijski element (tvar), a para je fizičko stanje vode.
Nadamo se da ste dobili dovoljno informacija tako da posjetite našu internetsku stranicu i na vaše pitanje smo odgovorili dovoljno detaljno.