Karakteristike vode, njezino stanje
Sastav tvari kao što je voda (kao i njegova kemijska formula) svima je poznat. Svaka od njegovih molekula sastoji se od tri atoma: atom kisika, označen slovom "O", i atomi vodika - latinski "H", u broju2. Oblik molekule vode nije simetričan (sličan jednakostraničnom trokutu).
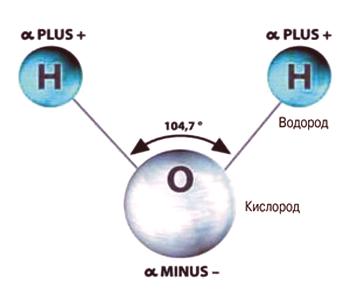
Molekula vode
Voda, kao supstanca, njezine molekule, reagira na vanjsku "okolinu", okolišne pokazatelje - temperaturu, tlak. Ovisno o potonjem, voda može promijeniti stanje, od kojih postoje tri:
- Uobičajeno, prirodno stanje vode je tekuće. Molekularna struktura (dihidrol) posebnog reda u kojem pojedinačne molekule ispunjavaju (vodikovim vezama) praznine.
- Stanje pare u kojoj je molekularna struktura (hidrol) predstavljena pojedinačnim molekulama između kojih ne nastaju vodikove veze.
- Kruto stanje (sam led) ima molekularnu strukturu (trihidrol) s jakim i stabilnim vodikovim vezama.
Osim ovih razlika, naravno, razlikuju se i načini "prelaska" tvari iz jednog stanja (tekućeg) u drugo. Ti prijelazi i transformiraju supstancu i izazivaju prijenos energije (oslobađanje /apsorpciju). Među njima su izravni procesi - pretvaranje tekuće vode u paru (isparavanje), u led (zamrzavanje) i obrnuto - u tekućinu iz pare (kondenzacije), iz leda (taljenje). Također, stanje vode - pare i leda - može se preobraziti jedna u drugu: sublimacija - led u paru, sublimacija - obrnuti proces.
Specifičnost leda kao stanja vode
Opće je poznato da led zamrzava (pretvara iz vode) kada prelazi temperaturu u smjeru smanjenja granice na nulu. Iako, uTo je sve jasan fenomen, postoje neke nijanse. Na primjer, stanje leda je dvosmisleno, njegove vrste i modifikacije su različite. Razlikuju se prvenstveno u uvjetima pod kojima nastaju - temperaturi, tlaku. Već je petnaest takvih izmjena.
Led u različitim oblicima ima različitu molekularnu strukturu (molekule se ne mogu razlikovati od molekula vode). Prirodni i prirodni led, u znanstvenoj terminologiji nazvanoj led Ih - tvar s kristalnom strukturom. To jest, svaka molekula sa svojim četiri "susjeda" koja je okružuje (udaljenost između svih je jednaka) stvara geometrijski oblik tetraedra. Druge ledene faze imaju složeniju strukturu, primjerice visoko uređenu strukturu trigonalnog, kubičnog ili monoklinskog leda.
Glavne razlike između leda i vode na molekularnoj razini
Prva, a ne izravno povezana s molekularnom strukturom vode i leda je razlika između njih - pokazatelj gustoće tvari. Kristalna struktura svojstvena ledu, kada se formira, doprinosi istovremenom smanjenju gustoće (od pokazatelja od gotovo 1000 kg /m3 do 916,7 kg /m3). To potiče povećanje volumena od 10%.Glavna razlika u molekularnoj strukturi ovih agregatnih stanja vode (tekuće i krute) uje količina, vrsta i snaga vodikovih veza između molekula . U ledu (čvrstom stanju) kombiniraju pet molekula, a vodikove veze su jače.
Molekule tvari vode i leda, kao što je ranije spomenuto, su iste. Ali atom u molekulama ledakisik (za stvaranje kristalne "rešetke" tvari) tvori vodikove veze (dvije) s molekulama "susjeda".Razlikuje supstancu vode u njenim različitim stanjima (agregativnim) ne samo strukturu rasporeda molekula (molekularnu strukturu), već i njihovo kretanje, snagu odnosa /privlačnost između njih. Molekule vode u tekućem stanju su prilično slabo privučene, osiguravajući fluidnost vode. U čvrstom ledu privlačnost molekula je najjača, stoga je njihova fizička aktivnost mala (osigurava stalnost oblika leda).