Opće informacije o atomima i ionima
Atom je najmanja čestica tvari koja posjeduje sva njegova svojstva. Polumjer atoma mjeri se u pikometrima (metrima). Atom je električno neutralan, tj. Struktura koja ne nosi naboje i sastoji se od jezgre i elektrona koji se okreću oko nje. Jezgra atoma sastoji se od protona i neutrona, koji se također nazivaju subatomske čestice. Proton nosi pozitivan naboj koji je jednak u veličini naboju elektrona. Neutroni nemaju troškove. Broj elektrona u atomu odgovara broju protona u jezgri, što čini atom kao cjelinu električki neutralnim.
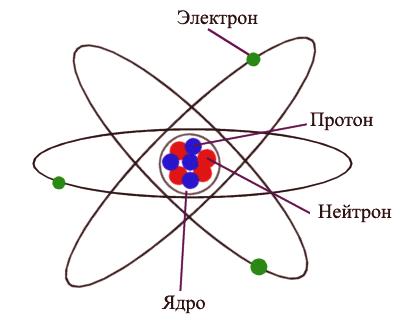
Atom
Ion je ne-elementarna čestica koja nosi pozitivan ili negativan naboj. Ion se proizvodi u procesu odvajanja ili vezanja elektrona na atom ili skupinu atoma. Ion s negativnim nabojem (atom s viškom elektrona) naziva se anion, a ion koji nosi pozitivan naboj (atom s nedostatkom elektrona) naziva se kation.
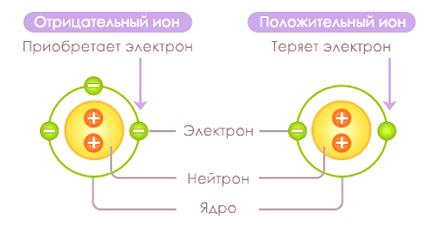
Ioni
Kako se stvaraju ioni
Ion se formira iz atoma u procesu koji se zoveionizacija . Kation nastaje kada elektron u atomu prima ionizacijsku energiju, omogućujući joj da prevlada potencijalnu barijeru i udalji se od atoma, prevladavajući sile elektrostatičke privlačnosti. Obrazovni procesAnion se pojavljuje s oslobađanjem energije kada atom prima dodatni elektron.
Ionizacija se može dogoditi zbog povećanja temperature, izlaganja električnom polju, rendgenskih zraka ili osvjetljavanja.
Ionizacija plinova
Vodik ima sličnu imovinu. Njegov atom ima jedan elektron i lako ga odaje, tvoreći kation.
Što je zajedničko između atoma i iona?
Atom i ion istog elementa imaju isti broj protona i neutrona u jezgri.Ion je označen istim simbolom kao i odgovarajući kemijski element u periodnom sustavu, s desne strane je prikazana samo vrijednost naboja.
Razlike između atoma i iona
Glavna razlika između atoma i iona je u tome što je ion napunjena čestica, a atom nije nabijen.Također, atom i ion istog elementa razlikuju se u masi zbog razlike u broju elektrona. Kation ima manju masu od atoma istog elementa, a anion je veći. Razlika između mase atoma i mase iona višestruka je mase elektrona.
Ioni, za razliku od atoma, ne posjeduju svojstva jednostavne tvari. Primjer za to su kristali joda, koji su u plinovitom stanju tamno plavi.ljubičasta, a njezini ioni su bezbojni. Jodni ioni ne daju boju reakcije sa škrobom i nisu otrovni, za razliku od kristala.
Sličan primjer jebakar . Ovaj metal ima zlatno-crvenu boju, a njegovi ioni su zeleno-plavi.Kalijje srebrni metal čiji atomi aktivno reagiraju s vodom, dok ioni ove tvari ne posjeduju to svojstvo. Ista razlika je karakteristična za svojstva atoma i natrijevih iona.
Vodikov kation u reakciji s amonijakom tvori amonijev ion. Za molekulu vodika, ova reakcija nije tipična.
Atomi se ne nalaze u prirodi sami, za razliku od iona. Jedini izuzeci su inertni plinovi koji reagiraju s drugim elementima samo u ekstremnim uvjetima. Ako se ion formira iz nekoliko atoma, onda se značajno razlikuje od atoma po veličini i strukturi. Za razliku od atoma, ion ne pripada elementarnim česticama.Ioni imaju potpunu vanjsku razinu energije - na njoj ima 8 elektrona. Nijedan atom osim inertnih plinova ne posjeduje ovo svojstvo.