Prije odgovora na pitanje postavljeno u naslovu članka, pogledajte što je par. Slike koje se pojavljuju u većini ljudi s ovom riječju: kipuće čajnik ili lonac, parna soba, topli napitak i još mnogo sličnih slika. Uostalom, u našim idejama postoji tekućina i plinovita tvar koja se diže iznad njezine površine. Ako se od vas traži da date primjer pare, odmah ćete se prisjetiti vodene pare, pare alkohola, etera, benzina, acetona.

Postoji još jedna riječ za plinovita stanja -plin . Ovdje se obično prisjećamo kisika, vodika, dušika i drugih plinova, a da ih ne povezujemo s odgovarajućim tekućinama. Poznato je da postoje u tekućem stanju. Na prvi pogled, razlike leže u činjenici da para odgovara prirodnim tekućinama, a plinovi moraju biti posebno ukapljeni. Međutim, to nije posve točno. Štoviše, slike koje proizlaze iz riječi par - para nisu. Da bismo dobili točniji odgovor, pogledajmo kako nastaje para.
Kako se para razlikuje od plina?
Agregatno stanje tvari određeno je temperaturom, točnije omjerom između energije s kojom molekule djeluju i energije njihovog toplinskog kaotičnog kretanja. Približno možemo pretpostaviti da je energija interakcije mnogo veća - čvrsto stanje, ako je energija toplinskog gibanja mnogo veća - plinovita, ako je usporediva energija - tekuća.
Molekula plina
Ispostavilo se da bi se molekula mogla odvojititekuće i sudjeluju u stvaranju pare, količina toplinske energije mora biti veća od energije interakcije. Kako se to može dogoditi? Prosječna brzina toplinskog kretanja molekula jednaka je određenoj vrijednosti, ovisno o temperaturi. Međutim, pojedinačne brzine molekula su različite: većina njih ima brzine bliske prosječnoj vrijednosti, ali neke od njih imaju brzine veće od prosjeka, a neke manje.
Brže molekule mogu imati toplinsku energiju veću od energije interakcije, i stoga, jednom na površini tekućine, mogu se odvojiti od nje, tvoreći paru. Ova metoda isparavanja naziva seisparavanjem . Zbog iste raspodjele brzina postoji suprotan proces - kondenzacija: molekule iz pare prolaze u tekućinu. Usput, slike koje se obično javljaju kada riječi parovi nisu para, već rezultat suprotnog procesa - kondenzacije. Para se ne može vidjeti.

Isparavanje
Pod određenim uvjetima, para može postati tekućina, ali zbog toga njezina temperatura ne smije prelaziti određenu vrijednost. Ta se vrijednost naziva kritična temperatura. Para i plin su plinovita stanja karakterizirana temperaturom na kojoj postoje. Ako temperatura ne prelazi kritičnu - paru, ako ona prelazi - plin. Ako se temperatura održava stalnom, a volumen smanjuje, para se ukapljuje, plin se ne otapa.
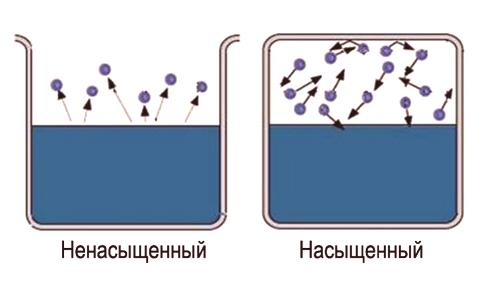
Što je zasićena i nezasićena para
Konačno, uspostavlja se stanje za koje će prosječni broj molekula koje se kreću iz jedne faze u drugu biti jednak. Ovo stanje se nazivadinamičkom ravnotežom . Ovo stanje karakterizira ista promjena veličine i smjera brzina isparavanja i kondenzacije. Ovo stanje odgovara zasićenom paru. Ako stanje dinamičke ravnoteže nije dostignuto, to odgovara nezasićenom paru.
Započnite proučavanje predmeta, uvijek sa svojim najjednostavnijim modelom. U molekularnoj kinetičkoj teoriji to je idealan plin. Ovdje su glavna pojednostavljenja zanemarivanje vlastitog volumena molekula i energija njihove interakcije. Pokazalo se da takav model sasvim zadovoljavajuće opisuje nezasićenu paru. I što je manje zasićena, to je njezina primjena legitimnija. Idealni plin je plin, on ne može postati ni para ni tekućina. Stoga, za zasićenu paru, ovaj model nijeadekvatna.
Glavne razlike između zasićene i nezasićene pare
- Zasićeno znači da objekt ima najveću moguću vrijednost nekih parametara. Za paru, to jegustoća i tlak . Ovi parametri za nezasićenu paru imaju manje vrijednosti. Što je parica dalje od zasićenja, to su manje vrijednosti. Jedno pojašnjenje: referentna temperatura bi trebala biti konstantna.
- Za nezasićenu paru zadovoljava seBoyle - Mariotteov zakon : ako su temperatura i masa plina konstantne, povećanje ili smanjenje volumena uzrokuje smanjenje ili povećanje tlaka za istu količinu, tlak i volumen su obrnuto proporcionalni. Iz maksimalne gustoće i tlaka na konstantnoj temperaturi slijedi njihova neovisnost od volumena zasićene pare, ispada da za zasićenu paru tlak i volumen ne ovise jedno o drugom.
- Za nezasićenu parugustoća ne ovisi o temperaturi , a ako je volumen očuvan, vrijednost gustoće se također ne mijenja. Za zasićenu paru, zadržavajući volumen, gustoća se mijenja ako se temperatura promijeni. Ovisnost u ovom slučaju je izravna. Ako se temperatura poveća, gustoća se povećava, ako se temperatura smanji, gustoća se također mijenja.
- Ako je volumen konstantan, nezasićena para se ponaša u skladu s Charlesovim zakonom: s porastom temperature tlak se povećava za isti iznos. Takav se odnos naziva linearnim. Kod zasićene pare s povećanim temperaturnim tlakomraste brže od nezasićene pare. Ovisnost je eksponencijalna.
Sumirajući, možemo uočiti značajne razlike u svojstvima uspoređenih objekata. Glavna razlika je u tome što se para, u stanju zasićenja, ne može smatrati izolirano od svoje tekućine. To je dvokomponentni sustav na koji se većina zakona o plinu ne može primijeniti.