Prije svega, morat ćete se pozabaviti terminologijom, jer ne samo mnogi smatraju termine “amonijak” i “amonijak” kao sinonime, nego se istovremeno odnose i na riječ “salična kiselina”, smatrajući je takvom “skraćenom verzijom” - što je apsolutno pogrešno. Dakle, amonijak je pravo ime samo jednog od mnogih mogućih spojeva dušika s vodikom, u kojem u svakoj molekuli postoje tri vodikova atoma po dušikovom atomu.
U normalnim uvjetima (tj. Sobnoj temperaturi i normalnom tlaku), ovaj spoj jeplin specifičnog, vrlo jakog mirisa . Termin "amonijak" se obično podrazumijeva kao slaba vodena otopina (ne više od 10%!) Amonijaka hidrata u vodi, uglavnom za medicinske primjene. Nenormalna skraćenica ovog naziva za "plaću" je pogrešna - jer potonja skriva krutu sol nastalu iz amonijaka i klorovodične kiseline, koja ima i čisto medicinsku i raznovrsnu uporabu u kućanstvu (na primjer, kao prehrambeni aditiv E510 ili fluks za lemljenje proizvoda od željeza) ,

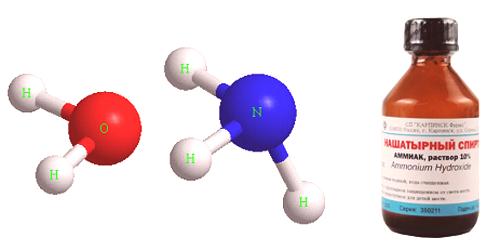
Molekula amonijaka
Odakle dolazi naziv "tekući amonijak"?
O ovom pitanju nema konsenzusa, ali sadašnja teorija glasi da su alkemičari, koji su se prvi put "ukrcali" na tu tvar, imali svoju vlastitu ideju o okolokemijskim esencijama, utemeljene na "duhovima" i "kvintesenciji". Na primjer, „duh vina“ ( spiritus vini ) je vinski (etil) alkohol, dobro poznata hlapljiva i mirisna tvar koja vinu daje određena svojstva.Amonijak je također vrlo nestabilan i mirisan, iako vrlo čudan - i stoga je odmah upisan u "odvajanje duhova".
Nespecijalistima je teško pratiti kako se, u kućnim uvjetima, amonijak može "pretvoriti" u amonijak i natrag, jer u zraku oko nas, barem u tragovima, uvijek ima vlage (vode), a amonijak joj, blago rečeno, vrlo ravnodušno “: pod sobnim uvjetima jedan volumen vode može otopiti oko 700 (to je točno sedam stotina!) ekvivalentnih količina plinovitog amonijaka, a pri nultom stupnju ta se brojka općenito povećava na ~ 1200 volumena!
Sam po sebi, amonijak se ukapljuje u lagani pokretni fluid na oko-33 ° C , nakon čega se može miješati s vodom u bilo kojem omjeru (s velikim masenim udjelom amonijaka, točnije je ne govoriti o »otopini amonijaka u vodi ", I o" otopini vode u amonijaku ").
Dakle, koje su najvažnije razlike između njih?
Već je gore spomenuto da je amonijak samo slaba otopina amonijevog hidrata u vodi za medicinske primjene. Zašto je to tako važno?
Prvo, amonijak se može proizvoditi i prodavati kao proizvod u obliku koncentriranih vodenih otopina ( od 25% i više ) - i takva rješenja u svakodnevnom životu su izuzetno opasna! Činjenica je da koncentrirane otopine amonijaka uvijek sadrže iznad svoje površine značajnu količinu tog plina, koji je 1,7 puta lakši od zraka.
Štoviše, njegov se hidrat lako raspada uz lagano zagrijavanje, što je u načelumože uzrokovati otpuštanje koncentriranog "plinskog jastuka" u lice kada otvara spremnik s njim. Zato ni slabom tekućem amonijaku ne treba odmah dati miris bez svijesti "iz boce", već je potrebno navlažiti pamučnu vunu /salvetu s njima - inače, umjesto uzbudljivog završetka živaca gornjih dišnih puteva (pojačano disanje), dolazi do zaustavljanja refleksa!
Drugo, koncentrirane vodene otopine amonijaka sukaustične , koje mogu lako oštetiti ne samo ljudske sluznice, nego i samu kožu (da ne spominjemo opće trovanje tijela kroz prodor kroz njega - jer amonijak dugotrajni kontakt „lako propušta“ kroz kožu i kroz tanku kućnu gumu).
Treće, čak je i jednostavno razrjeđivanje koncentrirane otopine na "alkoholne" uvjete s kasnijom uporabom potencijalno ispunjenonegativnim posljedicama , budući da su koncentrirane otopine obično "tehničke" i mogu sadržavati nestandardizirane količine nečistoća opasnih za ljude (općenito, ranije u industriji, takve su otopine slučajno dobivene tijekom koksiranja ugljena - i nakon svega u procesu se oslobađa masa teških kancerogenih tvari!)
Četvrto, s čisto kemijske točke gledišta,su različite tvari : amonijak je plin s kemijskom formulomNH3 , a amonijak je vodena otopina ovog plinskog hidrata (u starim udžbenicima). taj se spoj obično piše u oblikuNH4OH , u novijem se često koristiredukcija tipa NH3H20).