Anorganska kemija
Poznato je da ovo područje kemije proučavasva fizička i kemijska svojstva anorganskih tvari , kao i njihove spojeve, uzimajući u obzir njihov sastav, strukturu, kao i sposobnost za različite reakcije pomoću reagensa. iu njihovoj odsutnosti.

Obje su jednostavne i složene. Uz pomoć anorganskih tvari nastaju novi tehnički važni materijali koji su traženi među stanovništvom. Točnije, ovaj dio kemije bavi se proučavanjem onih elemenata i spojeva koji nisu stvoreni divljim životinjama i nisu biološki materijal, već se dobivajusintezom iz drugih tvari .
Tijekom nekih pokusa pokazalo se da su živa bića sposobna proizvesti mnoge anorganske tvari, kao i mogućnost sinteze organskih tvari u laboratoriju. No, unatoč tome, potrebno je razdvojiti ova dva područja međusobno, budući da postoje neke razlike u mehanizmima reakcija, strukturi i svojstvima tvari iz tih područja, koje ne dopuštaju da se sve kombinira.u jednom odjeljku.
Dodijelitijednostavne i složene anorganske tvari . Jednostavni spojevi uključuju dvije skupine spojeva - metale i nemetale. Metali su elementi koji imaju sva metalna svojstva, a postoji i metalna veza između njih. Ova skupina uključuje sljedeće tipove elemenata: alkalijske metale, zemnoalkalijske, tranzicijske, svjetlosne, polumetalne, lantanidne, aktinidne, magnezijeve i berilijeve. Od svih službeno priznatih elemenata periodičkog sustava, devedeset šest od sto osamdeset i jednog mogućeg elementa, što je više od polovice, klasificiraju se kao metali.
Najpoznatiji elementi iz nemetalnih skupina su kisik, silicij i vodik, a manje su arsen, selen i jod. Helij i vodik također su klasificirani kao jednostavni nemetali.Složene anorganske tvari podijeljene su u četiri skupine:
- Oksidi.
- Hidroksidi.
- Soli.
- Kiseline.
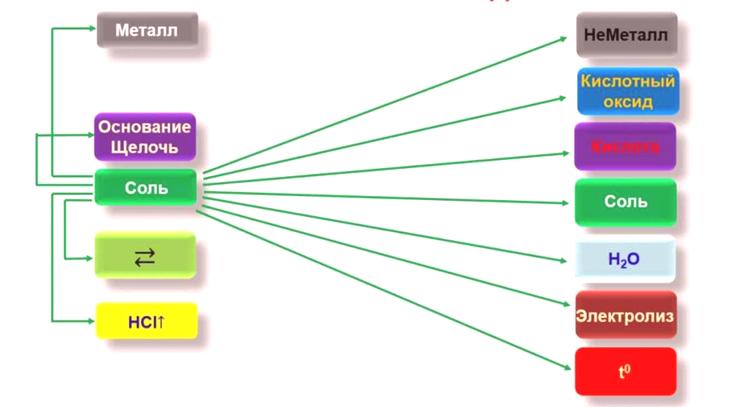
Dijagram interakcije soli s anorganskim spojevima
Organska kemija
Ovo polje kemije ispituje tvari koje se sastoje od ugljika i drugih elemenata, onih koji su s njom povezani, odnosno stvaraju takozvane organske spojeve. To mogu biti tvari anorganske prirode, budući da ugljikovodik može vezati različite kemijske elemente za sebe.

Organska kemija najčešće se bavi sintezom i preradom tvarii njihovih spojeva iz sirovina.biljnog, životinjskog ili mikrobiološkog podrijetla, iako je ta znanost, osobito u posljednje vrijeme, narasla daleko izvan naznačenog okvira.
Glavne skupine organskih spojeva uključuju: ugljikovodike, alkohole, fenole, spojeve koji sadrže halogene, etere i estere, aldehide, ketone, kinone, spojeve koji sadrže dušik i sumpor, karboksilne kiseline, heterocikličke, organometalne spojeve i polimere.
Tvari koje su proučavane organskom kemijom vrlo su raznolike, jer se zbog prisutnosti ugljikovodika u njihovom sastavu mogu vezati s mnogim drugim različitim elementima. Naravno, organske tvari su također uključene u sastav živih organizama u obliku masti, proteina i ugljikohidrata, koji obavljaju različite vitalne funkcije. Najvažnije su energetske, regulatorne, strukturne, zaštitne i druge. Oni su dio svake stanice, svakog tkiva i organa svakog živog bića. Bez njih je normalno funkcioniranje organizma u cjelini, živčanog sustava, reproduktivnog sustava i drugih nemoguće. To znači da sve organske tvari igraju veliku ulogu u postojanju života na zemlji.
Glavne razlike između njih
U načelu, ta su dva dijela međusobno povezana, ali imaju i neke razlike. Prije svega, sastav organskih tvari nužno uključujeugljik , za razliku od anorganskih tvari, u kojem se sastav ne može uključiti. Postoje i razlike u strukturi, sposobnostireagiraju na različite reagense i uvjete koji su stvoreni u strukturi, u osnovnim fizičkim i kemijskim svojstvima, u porijeklu, u molekularnoj težini i tako dalje.
U organskim tvarimamolekularna struktura je mnogo složenijanego ona anorganskih. Potonje se može rastopiti samo na dovoljno visokim temperaturama i vrlo je teško razgraditi, za razliku od organskih, koje imaju relativno nisku točku taljenja. Organska tvar ima prilično veliku molekularnu težinu.
Druga važna razlika je da samo organske tvari imaju sposobnostda formiraju spojeve s istim skupom molekula i atoma , ali koje imaju različite aranžmane. Tako se dobivaju potpuno različite tvari koje se razlikuju po fizičkim i kemijskim svojstvima. To znači da su organske tvari sklone takvom svojstvu kao izomerija.






