Podaci o stupnju oksidacije
Stupanj oksidacije je pomoćna količina koja se pripisuje atomu kemijskog elementa ili skupini atoma, što pokazuje kako su zajednički parovi elektrona raspodijeljeni između interakcijskih elemenata.
To je pomoćna vrijednost koja nema fizički smisao kao takav. Njegova suština je jednostavno objašnjena pomoću primjera:
Molekula jestive soliNaClsastoji se od dva atoma - atoma klora i atoma natrija. Veza između tih atoma je ionska. Natrij ima 1 elektron na razini valencije, što znači da ima jedan zajednički elektronski par s atomom klora. Od ta dva elementa, klor je više elektronegativan (ima svojstvo miješanja elektronskih parova sa samim sobom), tada će se jedini zajednički par elektrona prebaciti na njega. U spoju, element s višom elektronegativnošću ima negativno oksidacijsko stanje, manje elektronegativno, odnosno pozitivno, a njegova vrijednost jednaka je broju uobičajenih elektronskih parova. Za razmatranu molekulu NaCl, oksidacijska stanja natrija i klora izgledat će ovako:
+1 -1
NaCl
klor, selektronski par pristran u njega sada se smatra anionom, to jest atomom koji je pridodao dodatni elektron i natrij kao kationu, to jest atomu koji daruje elektron. No, kod snimanja stupnja oksidacije na prvom mjestu je znak, au drugom brojčana vrijednost, a pri snimanju ionskog naboja - obrnuto.
Stupanj oksidacije može se definirati kao broj elektrona kojima nedostaje pozitivni ion u elektroneutralnom atomu, ili koji se mora uzeti iz negativnog iona kako bi se oksidirao do atoma. U ovom primjeru, očito je da pozitivnom ionu natrija zbog pomaka elektronskog para nedostaje elektron, a ion klora ima jedan dodatni elektron.Stupanj oksidacije jednostavne (čiste) tvari, bez obzira na njegova fizička i kemijska svojstva, je nula. Primjerice, molekula O2sastoji se od dva atoma kisika. Oni imaju iste vrijednosti elektronegativnosti, tako da se uobičajeni elektroni ne pomiču ni na jedan od njih. To znači da je elektronski par strogo između atoma, jer će stupanj oksidacije biti nula.
Za neke molekule je teško odrediti gdje se elektroni kreću, osobito ako u njemu postoje tri ili više elemenata. Da biste izračunali stupanj oksidacije u takvim molekulama, trebate koristiti nekoliko jednostavnih pravila:
- Atom vodika gotovo uvijek ima konstantno oksidacijsko stanje +1 ..
- Za kisik, ovaj pokazatelj je -2. Jedina iznimka od ovog pravila su fluorid oksidi
+2 -1 +1 -1
OF2i O2F 2 ,
Budući da je fluor element s najvišom elektronegativnošću, stoga uvijek pomiče interakcijske elektrone prema sebi. Prema međunarodnim pravilima, prvo se bilježi element s nižom električno negativnom vrijednošću, jer je kisik na prvom mjestu u tim oksidima.- Ako sumiramo sva oksidacijska stanja u molekuli, dobivamo nulu. Pozitivno oksidacijsko stanje karakteristično je za atome metala.
Prilikom računanja oksidacijskih stanja treba imati na umu da je najveće oksidacijsko stanje elementa jednako broju njegove skupine, a najmanje jedan je broj skupine minus 8. Za klor maksimalno moguće oksidacijsko stanje je +7, jer je u 7. skupini, a minimum je 7 -8 = -1. 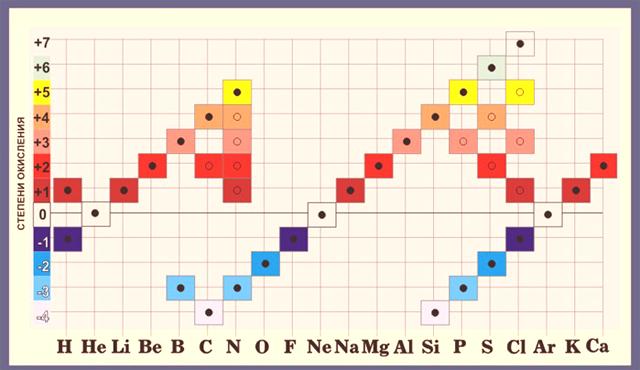
Opće informacije o valenciji
Valencija je broj kovalentnih veza koje element može oblikovati u različitim spojevima.
Za razliku od stupnja oksidacije, koncept valencije ima stvarno fizičko značenje.
Najveća valencija jednaka je broju skupine u periodnom sustavu. Sumpor S nalazi se u 6. grupi, tj. Njegova maksimalna valencija je 6. Ali ona također može biti 2 (H2S) ili 4 (SO2 ).
Gotovo svi elementi karakterizirani su promjenljivom valencijom. Međutim, postoje atomi za koje je ova vrijednost konstantna. To su alkalni metali, srebro, vodik (njihova valencija je uvijek 1), cink (valencija je uvijek 2), lantan (valencija je 3). 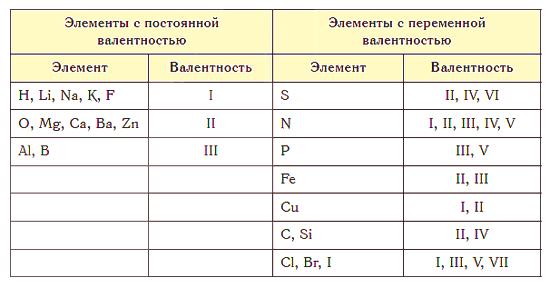
- Upućivanje na oboje, idruge vrijednosti koriste pozitivne brojeve, koji su zapisani iznad latinskog elementa elementa.
- Najviša valencija, kao i najveći stupanj oksidacije, podudara se s brojem skupine elementa.
- Stupanj oksidacije bilo kojeg elementa u složenom spoju podudara se s numeričkom vrijednošću jednog od valentnih pokazatelja. Na primjer, klor, koji je u 7. skupini, može imati valenciju od 1, 3, 4, 5, 6 ili 7, što znači da su mogući stupnjevi oksidacije ± 1, + 3, + 4, + 5, + 6, + 7.
Glavne razlike između tih pojmova
-
Koncept "valencije" ima fizičko značenje, a stupanj oksidacije je pomoćni pojam koji nema stvarno fizičko značenje.
- Stupanj oksidacije može biti nula, veći ili manji od nule. Valencija je strogo veća od nule.
- Valencija prikazuje broj kovalentnih veza i stupanj oksidacije - raspodjelu elektrona u spoju.







